Krebs zählt weltweit zu den Haupttodesursachen und stellt eine der größten Herausforderungen für die moderne Medizin dar. Die herkömmlichen Behandlungsansätze – Operation, Chemotherapie und Strahlentherapie – haben zwar Erfolge erzielt, sind jedoch oft mit schweren Nebenwirkungen und begrenztem Therapieerfolg bei fortgeschrittenen Tumoren verbunden.
In den letzten Jahrzehnten hat die zielgerichtete Therapie, insbesondere die Entwicklung von Protein-Kinase-Inhibitoren (PKIs), die Behandlung von Krebserkrankungen revolutioniert. Durch gezielte Eingriffe in zelluläre Signalwege ermöglichen PKIs, das Tumorwachstum spezifisch zu hemmen und dabei gesunde Zellen weitgehend zu schonen.
🧬 Was sind Protein-Kinasen und warum sind sie so bedeutend?
Protein-Kinasen sind Enzyme, die durch Übertragung einer Phosphatgruppe von ATP auf spezifische Aminosäuren in Zielproteinen (Serin, Threonin oder Tyrosin) die Funktion dieser Proteine regulieren. Diese Phosphorylierung steuert fundamentale Prozesse wie Zellteilung, Differenzierung, Apoptose (programmierter Zelltod) und Metabolismus.
Viele Krebsarten sind durch Überaktivierung oder Mutationen in bestimmten Kinasen gekennzeichnet, die dadurch kontinuierliche Wachstumssignale senden. Beispiele hierfür sind die BCR-ABL-Fusionskinase bei der chronischen myeloischen Leukämie (CML) oder mutierte EGFR-Kinasen bei Lungenkrebs.
🔍 Klassifizierung der Protein-Kinase-Inhibitoren
PKIs können grob in verschiedene Klassen unterteilt werden:
1. ATP-kompetitive Inhibitoren
Sie binden direkt an die ATP-Bindungsstelle der Kinase und verhindern so die Phosphorylierung. Diese Klasse ist am häufigsten vertreten.
2. Allosterische Inhibitoren
Sie binden an eine andere Stelle der Kinase als ATP und verändern deren Struktur, sodass die Aktivität blockiert wird.
3. Kovalente Inhibitoren
Diese binden irreversibel an die Kinase und inaktivieren sie dauerhaft.
4. PROTACs (Proteolysis Targeting Chimeras)
Innovative Moleküle, die Kinasen an das zelluläre Abbausystem (Proteasom) koppeln, um die Enzyme komplett zu eliminieren.
🧪 Wichtige Protein-Kinase-Inhibitoren in der Onkologie und ihre Anwendungsgebiete
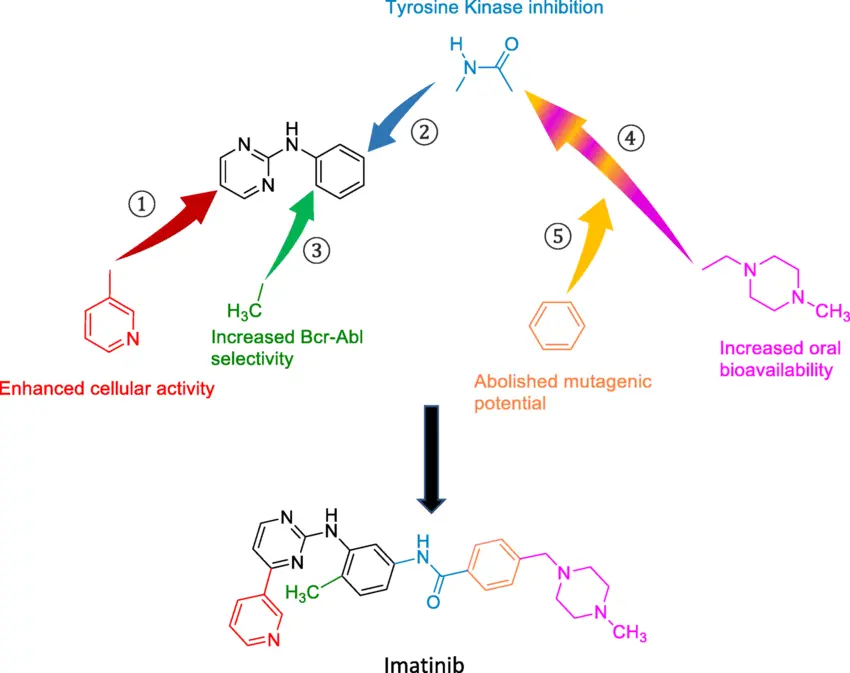
Einer der bekanntesten Inhibitoren ist Imatinib (Handelsname Gleevec), das gezielt die Fusionskinase BCR-ABL hemmt. Dieses Medikament hat die Behandlung der chronischen myeloischen Leukämie (CML) revolutioniert und wird zudem bei gastrointestinalen Stromatumoren (GIST) eingesetzt. Imatinib gilt als Meilenstein der zielgerichteten Krebstherapie.
Ein weiteres Beispiel ist Erlotinib (Tarceva), ein Inhibitor der Kinase des epidermalen Wachstumsfaktorrezeptors (EGFR). Es wird hauptsächlich bei nicht-kleinzelligem Lungenkrebs (NSCLC) mit aktivierenden EGFR-Mutationen eingesetzt und bietet eine effektive zielgerichtete Therapieoption.
Zur Behandlung des malignen Melanoms zielt Vemurafenib spezifisch auf die Mutation BRAF V600E ab, welche eine konstante Aktivierung des MAPK-Signalwegs verursacht. Dieser Wirkstoff verbessert die Überlebenschancen von Patienten mit metastasiertem Melanom deutlich.
Bei nicht-kleinzelligem Lungenkrebs mit genetischen Umlagerungen der Kinasen ALK oder ROS1 wird Crizotinib eingesetzt. Es blockiert diese aberranten Kinasen und verlangsamt so das Tumorwachstum.
Schließlich hemmt Palbociclib die cyclinabhängigen Kinasen CDK4/6, die eine entscheidende Rolle im Zellzyklus spielen. Dieses Medikament wird zur Behandlung hormonsensibler Brustkrebsarten verwendet und ist Teil innovativer Kombinationsstrategien.
🚀 Innovative Strategien zur Überwindung der Herausforderungen
Kombinationstherapien
Die gleichzeitige Gabe mehrerer Inhibitoren oder die Kombination mit Chemotherapie bzw. Immuntherapie kann Resistenzen reduzieren und Synergien erzielen.
Allosterische und kovalente Inhibitoren
Diese bieten neue Mechanismen, um Mutationen zu umgehen und die Kinase effektiver zu hemmen.
PROTACs
Durch gezielten Abbau der Kinase anstelle nur deren Hemmung können Resistenzmechanismen durch Überexpression oder Mutation überwunden werden.
Personalisierte Medizin
Sequenzierung des Tumorgenoms ermöglicht die Auswahl des jeweils besten Inhibitors für den individuellen Patienten.
🤖 Der Einfluss von Biotechnologie und künstlicher Intelligenz
Moderne biotechnologische Methoden und KI verändern die Entwicklung von PKIs grundlegend:
- Strukturvorhersage mit AlphaFold & Co. erlaubt die detaillierte Modellierung von Kinase-Strukturen, auch für bisher wenig untersuchte Varianten.
- Maschinelles Lernen beschleunigt das Screening großer Molekülbibliotheken und identifiziert potenzielle Wirkstoffkandidaten.
- Automatisierte Robotik-Labore erhöhen die Effizienz von Hochdurchsatz-Screenings.
- Multi-Omics-Daten unterstützen die Identifikation neuer therapeutischer Zielstrukturen und Biomarker.
🌍 Ausblick: Zukunft der Kinase-Therapien
Die nächste Generation von Protein-Kinase-Inhibitoren wird:
- Noch selektiver und weniger toxisch sein,
- Bessere Überwindung von Resistenzen ermöglichen,
- Durch Kombination mit Immuntherapien das Immunsystem aktivieren,
- Und zunehmend personalisiert auf einzelne Patientenprofile abgestimmt werden.
Mit fortschreitender Integration von Bioinformatik, synthetischer Biologie und Nanotechnologie entstehen völlig neue Therapieansätze, die weit über die heutigen Möglichkeiten hinausgehen.
Für weiterführende Informationen
Hier finden Sie einen aktuellen, umfassenden Artikel zu diesem Thema:
A comprehensive review of protein kinase inhibitors for cancer therapy